|
|
|
|
Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Download Reaktionen Spiele Gadgets Kontakt EnergiebändermodellWechselwirkungen von AtomhüllenWie bereits im Kapitel zu Atomen erläutert, bewegen sich die Elektronen auf festen Bahnen um den Atomkern. Jede dieser Bahnen entspricht einem diskreten Energieniveau und andere Energiezustände sind für die Elektronen innerhalb der Atomhülle "verboten". Nun, das gilt nur für ein einzelnes, isoliertes Atom. Wir haben bereits chemische Reaktionen als eine Sonderform von Interaktionen zwischen Elektronen verschiedener Atome kennen gelernt. Die Energieniveaus der Elektronen zweier voneinander isolierter Wasserstoffatome unterscheiden sich deutlich von den Niveaus zweier Wasserstoffatome, die über eine kovalente Bindung zu einem Wasserstoffmolekül verknüpft sind. Auch ohne die Ausbildung kovalenter Bindungen beeinflussen nahegelegene Atome die Energieniveaus der Elektronen in der Atomhülle. Die diskreten Energieniveaus werden leicht verschoben und werden zu Orbitalen mit einer leicht veränderten Form. Steigt die Anzahl benachbarter Atome, wird aus den vielen diskreten Energieniveaus mehr und mehr ein Kontinuum, das als Energieband angesehen werden kann.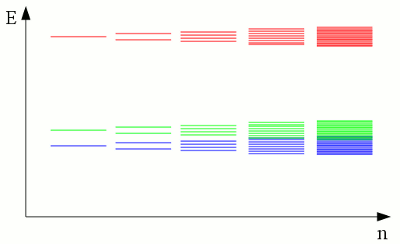
Die diskreten Energien der Hüllenelektronen benachbarter Atome teilen sich in leicht unterschiedliche Niveaus. Wird eine große Anzahl an Atomen in einem Kristallgitter, einer Flüssigkeit oder einem Gas zusammengebracht, steigt die Zahl der möglichen Energieniveaus stark an und die Differenz zwischen zwei Level wird sehr klein. Die einzelnen Energielevel isolierter Atome verschmelzen zu einem kontinuierlichen Energieband. Die beiden unteren Energiebänder überlappen (Blau und Grün), während eine Lücke zwischen dem grünen und roten Energieband verbleibt. LeitfähigkeitDie Elektronenhülle in einem Atom wird so besetzt, dass die Energie des gesamten Atoms so niedrig wie möglich ist. Dieser Zustand wird als Grundzustand bezeichnet. Die äußersten Elektronen der Hülle werden dabei als Valenzelektronen bezeichnet, entsprechend nennt man das äußerste Energieband Valenzband. Durch Energieaufnahme können Elektronen eines isolierten Atoms auf höhere Bahnen angehoben oder im Extremfall sogar ganz von dem Atomkern abgetrennt werden (Ionisierung). Diese freien Elektronen können von einem anderen Atom eingefangen werden, womit das Elektron zwischen zwei Atomen ausgetauscht wird. In einem Kristallgitter ist die zum Austausch von Elektronen benötigte Energie wesentlich kleiner als die Ionisierungsenergie, weil die Atomkerne wesentlich näher beieinander liegen. Die minimal nötige Energie zum Elektronentransfer in einem Kristallgitter kann einem Energieband zugeordnet werden, das als Leitungsband bezeichnet wird: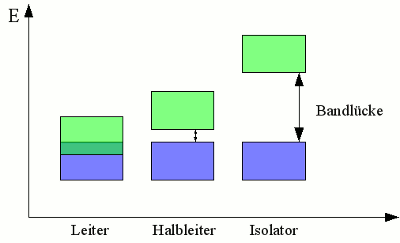
Valenzband (Blau) und Leitungsband (Grün) verschiedener Materialien. Die Energiebreite beziehungsweise -höhe von Valenz- und Leitungsband hängt vom verwendeten Material ab. Überlappen sich die Energieniveaus der beiden Bänder, können Elektronen ohne Energiezufuhr zwischen den einzelnen Atomen wechseln. Die Elektronen können sich frei in dem Kristallgitter bewegen und ein elektrischer Strom fließt, sobald das Material mit einer Spannungsquelle verbunden wird. Diese Materialien werden Leiter genannt, weil sie eine hohe Leitfähigkeit für elektrischen Strom besitzen. Sind Leitungs- und Valenzband durch eine Bandlücke voneinander getrennt, können sich die Elektronen nicht frei zwischen verschiedenen Atomen bewegen. Es wird zusätzliche Energie benötigt, um die Elektronen vom Valenz- in das Leitungsband zu heben. Abgesehen von dem absoluten Temperatur-Nullpunkt, werden immer einige Elektronen aufgrund thermischer Energie in das Leitungsband angehoben. Je kleiner die Bandlücke, um so mehr Elektronen befinden sich im Leitungsband, wodurch die Leitfähigkeit dieser Materialien höher ist. Je größer die Bandlücke, um so geringer wird die Elektronenzahl im Leitungsband, wodurch die Leitfähigkeit dieser Materialien herabgesetzt ist. Ein Material mit einer kleinen Bandlücke nennt man Halbleiter, ein solches mit einer großen Bandlücke Nichtleiter oder Isolator Die Anzahl der in das Leitungsband gehobenen Elektronen hängt von der Umgebungstemperatur ab, womit die Leitfähigkeit von Halbleitern und Isolatoren mit der Temperatur steigt. Diese Materialien nennt man daher auch Heißleiter oder NTC-Widerstand (englisch für Negative Temperature Coefficient). Im Gegensatz dazu steigt der Widerstand metallischer Leiter mit der Temperatur, weswegen diese als Kaltleiter oder PTC Widerstände (englisch für Positive Temperature Coefficient) bezeichnet werden. Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Archiv Download Reaktionen Spiele Verweise Gadgets Kontakt Impressum |
|
|